Matukio asilia na michakato inayotuzunguka ni changamano sana. Kwa maelezo yao halisi ya kimwili, kifaa cha kihesabu kigumu kinapaswa kutumika na idadi kubwa ya mambo muhimu yanapaswa kuzingatiwa. Ili kuepuka tatizo hili, baadhi ya mifano iliyorahisishwa hutumiwa katika fizikia, ambayo inawezesha sana uchambuzi wa hisabati wa mchakato, lakini kwa kweli haiathiri usahihi wa maelezo yake. Mmoja wao ni mfano bora wa gesi. Hebu tuzingatie kwa undani zaidi katika makala.
Dhana ya gesi bora
Gesi bora ni hali ya mkusanyo wa dutu, ambayo inajumuisha nukta nyenzo ambazo haziingiliani. Hebu tueleze ufafanuzi huu kwa undani zaidi.
Kwanza, tunazungumza kuhusu nyenzo kama vitu vinavyounda gesi bora. Hii ina maana kwamba molekuli zake na atomi hazina ukubwa, lakini zina molekuli fulani. Ni ujasiriukadiriaji unaweza kufanywa kwa kuzingatia ukweli kwamba katika gesi zote halisi katika shinikizo la chini na joto la juu, umbali kati ya molekuli ni kubwa zaidi kuliko vipimo vyake vya mstari.
Pili, molekuli katika gesi bora hazipaswi kuingiliana. Kwa kweli, mwingiliano kama huo upo kila wakati. Kwa hivyo, hata atomi za gesi nzuri hupata mvuto wa dipole-dipole. Kwa maneno mengine, mwingiliano wa van der Waals upo. Hata hivyo, ikilinganishwa na nishati ya kinetic ya mzunguko na harakati ya tafsiri ya molekuli, mwingiliano huu ni mdogo sana kwamba hauathiri mali ya gesi. Kwa hivyo, haziwezi kuzingatiwa wakati wa kutatua shida za vitendo.
Ni muhimu kutambua kwamba sio gesi zote ambazo msongamano ni wa chini na halijoto ni ya juu zinaweza kuchukuliwa kuwa bora. Kando na mwingiliano wa van der Waals, kuna aina nyingine, zenye nguvu zaidi za vifungo, kwa mfano, vifungo vya hidrojeni kati ya molekuli H2O, ambayo husababisha ukiukaji mkubwa wa hali bora ya gesi. Kwa sababu hii, mvuke wa maji si gesi bora, lakini hewa ni.
Mtindo halisi wa gesi bora
Muundo huu unaweza kuwakilishwa kama ifuatavyo: tuseme kuwa mfumo wa gesi una chembechembe za N. Hizi zinaweza kuwa atomi na molekuli za kemikali na vipengele mbalimbali. Idadi ya chembe za N ni kubwa, kwa hivyo kitengo cha "mole" kawaida hutumiwa kuielezea (mole 1 inalingana na nambari ya Avogadro). Zote husogea katika mwendo wa kiasi cha V. Chembeni machafuko na huru ya kila mmoja. Kila moja yao ina kasi fulani v na husogea kwenye njia iliyonyooka.
Kinadharia, uwezekano wa mgongano kati ya chembe ni karibu sufuri, kwa kuwa saizi yao ni ndogo ikilinganishwa na umbali kati ya chembe. Hata hivyo, ikiwa mgongano huo hutokea, basi ni elastic kabisa. Katika hali ya mwisho, jumla ya kasi ya chembe na nishati yao ya kinetiki huhifadhiwa.
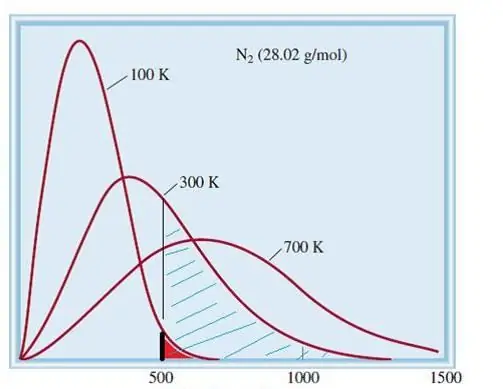
Mfano unaozingatiwa wa gesi bora ni mfumo wa kitambo wenye idadi kubwa ya vipengele. Kwa hiyo, kasi na nishati ya chembe ndani yake hutii usambazaji wa takwimu wa Maxwell-Boltzmann. Baadhi ya chembe zina kasi ya chini, wakati wengine wana kasi ya juu. Katika kesi hii, kuna kikomo fulani cha kasi nyembamba, ambacho maadili yanayowezekana zaidi ya idadi hii iko. Usambazaji wa kasi wa molekuli za nitrojeni umeonyeshwa kwa mpangilio hapa chini.
Nadharia ya kinetic ya gesi
Muundo wa gesi bora uliofafanuliwa hapo juu hubainisha sifa za gesi kwa kipekee. Mtindo huu ulipendekezwa kwa mara ya kwanza na Daniel Bernoulli mnamo 1738.

Baadaye, ilitengenezwa kwa hali yake ya sasa na August Kroenig, Rudolf Clausius, Mikhail Lomonosov, James Maxwell, Ludwig Boltzmann, Marian Smoluchowski na wanasayansi wengine.
Nadharia ya kinetic ya dutu za maji, kwa msingi ambao muundo bora wa gesi umeundwa, inaelezea sifa mbili muhimu za mfumo mkuu kulingana na tabia yake ya hadubini:
- Shinikizo katika gesi ni matokeo ya mgongano wa chembe na kuta za chombo.
- Joto katika mfumo ni tokeo la udhihirisho wa msogeo thabiti wa molekuli na atomi.
Wacha tupanue hitimisho zote mbili za nadharia ya kinetiki.
Shinikizo la gesi
Muundo bora wa gesi huchukua mwendo wa fujo wa kila mara wa chembe katika mfumo na mgongano wao wa mara kwa mara na kuta za chombo. Kila mgongano huo unachukuliwa kuwa elastic kabisa. Uzito wa chembe ni ndogo (≈10-27-10-25 kg). Kwa hiyo, haiwezi kuunda shinikizo nyingi katika mgongano. Hata hivyo, idadi ya chembe, na hivyo basi idadi ya migongano, ni kubwa (≈1023). Kwa kuongeza, mzizi unamaanisha kasi ya mraba ya vipengele ni mita mia kadhaa kwa pili kwa joto la kawaida. Yote hii inasababisha kuundwa kwa shinikizo la kufahamu kwenye kuta za chombo. Inaweza kuhesabiwa kwa kutumia fomula ifuatayo:
P=Nmvcp2 / (3 V), ambapo vcp ni mzizi wa kasi ya mraba, m ni uzani wa chembe.
joto kamili
Kulingana na muundo bora wa gesi, halijoto hubainishwa kipekee na wastani wa nishati ya kinetiki ya molekuli au atomi katika mfumo unaofanyiwa utafiti. Unaweza kuandika usemi ufuatao unaohusiana na nishati ya kinetiki na halijoto kamili kwa gesi bora:
mvcp2 / 2=3 / 2kB / T.
Hapa kB ni mfumo thabiti wa Boltzmann. Kutokana na usawa huu tunapata:
T=m vcp2 / (3kB).
).
Mlinganyo wa hali ya jumla
Tukichanganya vielezi vilivyo hapo juu kwa shinikizo kamili P na halijoto kamili T, tunaweza kuandika usawa ufuatao:
PV=nRT.
Hapa n ni kiasi cha dutu katika moles, R ni gesi isiyobadilika iliyoletwa na D. I. Mendeleev. Usemi huu ndio mlinganyo muhimu zaidi katika nadharia ya gesi bora, kwa sababu unachanganya vigezo vitatu vya thermodynamic (V, P, T) na hautegemei sifa za kemikali za mfumo wa gesi.

Mlinganyo wa ulimwengu wote ulitolewa kwa majaribio na mwanafizikia Mfaransa Emile Clapeyron katika karne ya 19 na kisha kuletwa katika hali yake ya kisasa na mwanakemia wa Kirusi Mendeleev, ndiyo maana kwa sasa ina majina ya wanasayansi hawa.






