Mojawapo ya maswali muhimu katika utafiti wa mifumo ya thermodynamic katika fizikia ni swali la iwapo mfumo huu unaweza kufanya kazi fulani muhimu. Kuhusiana kwa karibu na dhana ya kazi ni dhana ya nishati ya ndani. Katika makala haya, tutazingatia nishati ya ndani ya gesi bora ni nini na kutoa fomula za kuikokotoa.
gesi bora
Kuhusu gesi, kama hali ya mkusanyiko, ambayo haina nguvu yoyote elastic chini ya ushawishi wa nje juu yake na, kwa sababu hiyo, haibaki kiasi na sura, kila mtoto wa shule anajua. Dhana ya gesi bora kwa wengi bado haieleweki na haijulikani. Hebu tueleze.
Gesi bora ni gesi yoyote inayokidhi masharti mawili muhimu yafuatayo:
- Chembe zinazoiunda hazina ukubwa. Zina saizi, lakini ni ndogo sana ikilinganishwa na umbali kati yao kwamba inaweza kupuuzwa katika hesabu zote za hisabati.
- Chembe haziingiliani kwa kutumia nguvu au nguvu za van der Waalsasili nyingine. Kwa kweli, katika gesi zote halisi, mwingiliano kama huo upo, lakini nishati yake ni kidogo ikilinganishwa na wastani wa nishati ya chembe za kinetic.
Hali zilizoelezwa hutoshelezwa na takriban gesi zote halisi, halijoto ambayo ni zaidi ya 300 K, na shinikizo halizidi angahewa moja. Kwa shinikizo la juu sana na joto la chini hutazama kupotoka kwa gesi kutoka kwa tabia bora. Katika kesi hii, mtu anazungumzia gesi halisi. Zinafafanuliwa na mlinganyo wa van der Waals.
Dhana ya nishati ya ndani ya gesi bora
Kulingana na ufafanuzi, nishati ya ndani ya mfumo ni jumla ya nishati za kinetiki na zinazowezekana zilizomo ndani ya mfumo huu. Ikiwa dhana hii inatumiwa kwa gesi bora, basi sehemu inayowezekana inapaswa kuachwa. Hakika, kwa kuwa chembe za gesi bora haziingiliani, zinaweza kuzingatiwa kama kusonga kwa uhuru katika utupu kabisa. Ili kutoa chembe moja kutoka kwa mfumo unaofanyiwa utafiti, si lazima kufanya kazi dhidi ya nguvu za ndani za mwingiliano, kwa kuwa nguvu hizi hazipo.
Kwa hivyo, nishati ya ndani ya gesi bora kila wakati huambatana na nishati yake ya kinetiki. Mwisho, kwa upande wake, ni wa kipekee kuamua na molekuli ya molar ya chembe za mfumo, idadi yao, pamoja na kasi ya wastani ya mwendo wa kutafsiri na wa mzunguko. Kasi ya harakati inategemea joto. Kuongezeka kwa halijoto husababisha kuongezeka kwa nishati ya ndani, na kinyume chake.
Mfumo wanishati ya ndani
Onyesha nishati ya ndani ya mfumo bora wa gesi yenye herufi U. Kulingana na thermodynamics, inafafanuliwa kuwa tofauti kati ya enthalpy H ya mfumo na bidhaa ya shinikizo na sauti, yaani:
U=H - pV.
Katika aya iliyo hapo juu, tuligundua kuwa thamani ya U inalingana na jumla ya nishati ya kinetiki Ekya chembe zote za gesi:
U=Ek.
Kutoka kwa mitambo ya takwimu, ndani ya mfumo wa nadharia ya kinetiki ya molekuli (MKT) ya gesi bora, inafuata kwamba wastani wa nishati ya kinetiki ya chembe moja Ek1 ni sawa na thamani ifuatayo:
Ek1=z/2kBT.
Hapa kB na T - Boltzmann thabiti na halijoto, z - idadi ya digrii za uhuru. Jumla ya nishati ya kinetiki ya mfumo Ek inaweza kupatikana kwa kuzidisha Ek1 kwa idadi ya chembe N kwenye mfumo:
Ek=NEk1=z/2NkBT.
Kwa hivyo, tumepata fomula ya nishati ya ndani ya gesi bora, iliyoandikwa kwa umbo la jumla kulingana na halijoto kamili na idadi ya chembe katika mfumo funge:
U=z/2NkBT.
Monatomiki na gesi ya polyatomiki
Mfumo wa U iliyoandikwa katika aya iliyotangulia ya makala haifai kwa matumizi yake ya vitendo, kwa kuwa ni vigumu kubainisha idadi ya chembe N. Hata hivyo, ikiwa tutazingatia ufafanuzi wa kiasi cha dutu n, basi usemi huu unaweza kuandikwa upya kwa njia inayofaa zaidi:
n=N/NA; R=NAkB=8, 314 J/(molK);
U=z/2nR T.
Idadi ya digrii za uhuru z inategemea jiometri ya chembe zinazounda gesi. Kwa hiyo, kwa gesi ya monoatomic, z=3, kwani atomi inaweza kusonga kwa kujitegemea tu katika pande tatu za nafasi. Ikiwa gesi ni diatomic, basi z=5, kwa kuwa digrii mbili zaidi za mzunguko wa uhuru huongezwa kwa digrii tatu za kutafsiri za uhuru. Hatimaye, kwa gesi nyingine yoyote ya polyatomic, z=6 (digrii 3 za kutafsiri na 3 za mzunguko wa uhuru). Kwa kuzingatia hili, tunaweza kuandika katika muundo ufuatao fomula za nishati ya ndani ya gesi bora ya monatomic, diatomic na polyatomic:
U1=3/2nRT;
U2=5/2nRT;
U≧3=3nRT.
Mfano wa kazi ya kubainisha nishati ya ndani
Silinda ya lita 100 ina hidrojeni safi katika shinikizo la angahewa 3. Kwa kuchukulia hidrojeni kuwa gesi bora chini ya hali fulani, ni muhimu kubainisha nishati yake ya ndani ni nini.

Fomula zilizo hapo juu za U zina kiasi cha dutu na halijoto ya gesi. Katika hali ya shida, hakuna chochote kinachosemwa juu ya idadi hii. Ili kutatua tatizo, ni muhimu kukumbuka equation ya Clapeyron-Mendeleev ya ulimwengu wote. Ina mwonekano unaoonyeshwa kwenye mchoro.
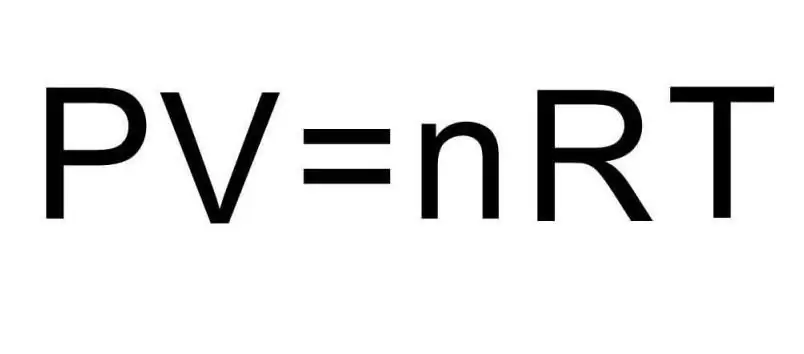
Kwa vile hidrojeni H2 ni molekuli ya diatomiki, fomula ya nishati ya ndani ni:
UH2=5/2nRT.
Tukilinganisha semi zote mbili, tunafika kwenye fomula ya mwisho ya kutatua tatizo:
UH2=5/2PV.
Inasalia kubadilisha vitengo vya shinikizo na sauti kutoka kwa hali hadi mfumo wa SI wa vitengo, kubadilisha maadili yanayolingana katika fomula ya UH2na kupata jibu: UH2 ≈ 76 kJ.






